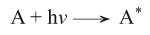كيمياء ضوئية
الكيمياء الضوئية Photochemistry هى فرع من فروع علم الكيمياء ، و يشمل دراسة التفاعلات بين كلا من الذرة ، الجزيئات الصغيرة و الضوء(أو الاشعاع الكهرومغناطيسى).
مثله كمثل كل الفروع العلمية فأن الكيمياء الضوئية تستخدم النظام الدولى SI أو نظام القياس المترى.
الوحدات المهمة و الثوابت التى يتم إستخدامها بكثرة تتضمن الأمتار(و أشكاله المختلفة مثل السنتيمتر ، الميليمتر ، الميكرومتر ، النانومتر ، و هكذا ..) و الثوانى ، الهرتز ، الجول ، المول ، ثابت الغاز R و ثابت بولتزمان.
هذه الوحدات و الثوابت متكاملة أيضا مع مجال كيمياء الطبيعة.
التفاعلات الضوكيميائية جزء من عمليات طبيعية كثيرة. ففي التركيب الضوئي، على سبيل المثال، تمتص النباتات الخضراء ضوء الشمس، ثم تستخدم هذه الطاقة الضوئية لإنتاج الغذاء، من ثاني أكسيد الكربون من الهواء، ومن ماء التربة. انظر : التركيب الضوئي. وهكذا يحول النبات الطاقة المشعة للضوء إلى طاقة كيميائية للغذاء. ومن خلال عمليات جيولوجية، تتحول النباتات إلى فحم حجري أو نفط. وعند احتراق هذا الوقود، تنطلق طاقة الضوء التي اخُتزنت في النباتات منذ ملايين السنيين.
تشمل العمليات الصناعية الكثيرة أيضاً تغيرات ضوكيميائية. ففي التصوير الضوئي، على سبيل المثال، تمتص بعضُ أملاح الفضة في فيلم التصوير الضَّوءَ عند التقاط الصورة. ويغيّر الضوءُ الممتصّ هذه الأملاح كيميائياً. وعندما يُحمَّض الفيلم تُصدر الأملاح المتغيرة صوراً مظلمة على السالب.
يتضمن البحث في الكيمياء الضوئية هذه الأيام تطوير الاستخدمات التقنية للطاقة الشمسية. ويسعى بعض علماء الكيمياء الضوئية إلى إيجاد طرق لتقليد عملية التركيب الضوئي بذرات مُخَلَّقة اصطناعيا. ويأمل هؤلاء الكيميائيون في تحويل ضوء الشمس إلى كهرباء بطريقة أكثر كفاءة مما هو ممكن الآن. ويدرس كيميائيون آخرون سبلاً لاستخدام ضوء الشمس في إنتاج أنواع من الوقود، مثل غاز الهيدروجين والميثانول. وتشمل بعض هذه الطرق تفتيت ذرات الماء مع الطاقة الشمسية.
قوانين الكيمياء الضوئية
يعرف قانونان أساسيان في الكيمياء الضوئية:
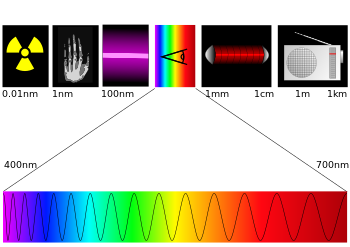
المناطق الطيفية
تطبيقات
تستعمل التفاعلات الكيمياوية الضوئية في اصطناع الجزيئات العضوية. كما أن كثيراً من العمليات العادية هي كيمياوية ضوئية في طبيعتها ولها تطبيقات عديدة، مثال ذلك: الاصطناع الضوئي (التمثيل الكلوروفيلي) photosynthesis، حيث يمتص الكلوروفيل في النبات الضوءَ لكي ينتج السكاكر carbohydrates، وهي مواد عضوية، من ثنائي أكسيد الكربون CO2 والماء H2O، المادتين اللاعضويتين، والتفاعلات الجارية خلال حدوث الرؤية في العين التي مازالت غير مفهومة حتى وقتنا الحالي. ويعتمد التصوير الضوئي photography على فعل الضوء في حبيبات كلوريد الفضة AgCl أو بروميد الفضة AgBr لإنتاج الصور. ويتكوَّن الأوزونO3 في طبقات الجو العليا بفعل الضوء على جزيئات الأكسجين O2.
والخلايا الشمسية التي تمد الأقمار الصناعية والمركبات الفضائية تحوِّل الطاقة الشمسية إلى طاقة كهربائية. فالتفاعلات الكيمياوية العادية تتم (ولو جرت في الظلام) بتوفير طاقة التنشيط activation energy اللازمة لها بوساطة الاصطدامات العشوائية المتتالية بين الدقائق (الجزيئات أو الذرات) المتفاعلة. أما في التفاعلات الكيمياوية الضوئية فتحصل الجزيئات أو الذرات المتفاعلة على طاقة التنشيط بامتصاص كمّ الطاقة الشعاعية وفق علاقة بلانك E =hnν حيث h ثابتة بلانك، وهو يساوي 6.624 جول × ثا، ν تردد (أو تواتر) الإشعاع.
الإعدادات التجريبية


Schlenk tubecontaining slurry of orange crystals of Fe2(CO)9 in acetic acid after its photochemical synthesis from Fe(CO)5. The mercury lamp (connected to white power cords) can be seen on the left, set inside a water-jacketed quartz tube.
لكي تبدأ العملية الكيمياوية الضوئية يلزم أن تمتص الذرة أو الجزيء طاقة ضوئية أو «كماً» quantum من الطاقة هو الفوتون. وعندها تزداد طاقة هذه الذرة أو الجزيء وتصبح أعلى من مستواها الطبيعي، أو تصبح في حالة مهيّجة (أو منشَّطة). وعندما يُمتص «كم» ضوء مرئي أو أشعة فوق بنفسجية يرتفع إلكترون موجود في سوية طاقية منخفضة نسبياً في الذرة أو الجزيء إلى سوية طاقية أعلى. أما إذا امتُص كم من أشعة تحت الحمراء فتتأثر عندها حركات الذرات في الجزيء.
وبعد الامتصاص المبدئي للأشعة، يُجري الجزيء المهيَّج عدداً من العمليات الكيمياوية الضوئية الأولية. والعملية الأولية تدل على التحول الذي يحدث مباشرة عندما يُمتَص فوتون ضوئي واحد في جزيء واحد. وتجري عملية ثانوية (أو عمليات ثانوية عدة) بعد الخطوة الأولية. فإذا رُمِز للجزيء بالرمز A وحدث امتصاص الفوتون الضوئي hnν، أمكن كتابة ذلك على النحو الآتي:
وتدل A* على الجزيء المهيَّج بعد امتصاصه الفوتونَ المناسب طاقياً.
الإثارة
يمتص الضوء في شكل كميات صغيرة من الطاقة المشعة فوتونات. وتعتمد طاقة الفوتون على طول موجة الضوء. وبعد امتصاص أحد الفوتونات، تزداد طاقة الجزيء ويكون في حالة إثارة. في معظم الحالات، يبقى الجزيء على هذه الحالة فقط واحدًا على مليون من الثانية أو أقل. وأحيانًا يعود الجزيء مباشرة لحالته العادية بِفقْدِ الطاقة المكتسبة في التصادمات مع الذرات الأخرى، أو بإطلاقها على هيئة ضوء. لكن إذا كان الطول الموجي لفوتون الضوء الممتص قصير ـ كما في الضوء المرئيّ ـ فإن الجزيء رُبمَّا يكون قد تلقى طاقة كافية ليمر بالتفاعلات الكيميائية غير العادية، بينما هو في حالة إثارة.
العمليات الكيمياوية الضوئية الأولية
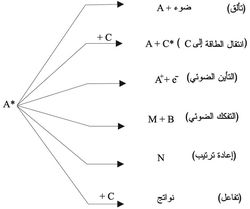
يبيّن المخطط الآتي مختَلف العمليات الأولية التي يمكن أن تطرأ على الجزيء المهيَّج A*:
فالجزيء المنشَّط (ذو الطاقة العالية) يرجِع إلى حالته البدائية حسب إحدى العمليات الفيزيائية الآتية:
(1) يطلق طاقته المهيِّجة بالتألقluminescence.
(2) قد ينقل طاقته إلى جزيء آخر، C، يصطدم معه من دون إصدار ضوء. فيتحول A* المهيَّج إلى الجزيء الطبيعي A ويتحول C إلى C*
(3) قد يمتص إلكترون e- في عملية امتصاص الضوء الأولي طاقة كبيرة ما يؤدي إلى انفصاله عن الذرة أو الجزيء، فيتحول A إلى الأيون الموجب A+ وتسمى هذه العملية التأين الضوئي photoionization.
إن امتصاص طاقة التحريض يعمل على كسر الروابط الكيمياوية أو إعادة ترتيبها، وهذا يؤدي إلى حدوث تفاعلات كيمياوية مثل: التفكك الضوئي photodissociation، وإعادة ترتيب rearrangement الجزيء، والتفاعل مع جزيء آخر C. ففي التفكك الضوئي تنكسر A* متحولة إلى شدف جزيئية M وB أو ذرات. أما في إعادة الترتيب (أو التماكبية الضوئية photoisomerization مثل تحول البوتان إلى إيزوبوتان) فيتحول A إلى N، وهو جزيء يتألف من الذرات نفسها المؤلفة لـ A وعددها نفسه ولكن الترتيب البنيوي للذرات فيهما مختلف.
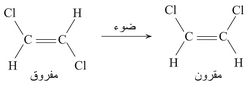
مثال ذلك تحول ثنائي كلورو الإتيلين المفروق trans إلى المماكب المقرون cis:
ففي المماكب المفروق تقع ذرتا الكلور باتجاهين متعاكسين بالنسبة للروابط المضاعفة، في حين هما تقعان في جهة واحدة من الرابطة المزدوجة في المماكب المقرون. وإذا أريدت الدقة تماماً فإن أمثال التحولات الثلاثة الأخيرة هي الموضوعات التي تُعنى بها الكيمياء الضوئية، إلا أن جميع التآثرات المذكورة في المخطط تندرج عادة ضمن الكيمياء الضوئية.
العمليات الكيمياوية الضوئية الثانوية
وتجري بعد إتمام الخطوة الأولية، مثال ذلك تكوّن الأوزون، وتحطّمه في طبقات الستراتوسفير، والتفاعلات المتسلسلة.
الكيمياء الضوئية Photochemistry هى فرع من فروع علم الكيمياء ، و يشمل دراسة التفاعلات بين كلا من الذرة ، الجزيئات الصغيرة و الضوء(أو الاشعاع الكهرومغناطيسى).
مثله كمثل كل الفروع العلمية فأن الكيمياء الضوئية تستخدم النظام الدولى SI أو نظام القياس المترى.
الوحدات المهمة و الثوابت التى يتم إستخدامها بكثرة تتضمن الأمتار(و أشكاله المختلفة مثل السنتيمتر ، الميليمتر ، الميكرومتر ، النانومتر ، و هكذا ..) و الثوانى ، الهرتز ، الجول ، المول ، ثابت الغاز R و ثابت بولتزمان.
هذه الوحدات و الثوابت متكاملة أيضا مع مجال كيمياء الطبيعة.
التفاعلات الضوكيميائية جزء من عمليات طبيعية كثيرة. ففي التركيب الضوئي، على سبيل المثال، تمتص النباتات الخضراء ضوء الشمس، ثم تستخدم هذه الطاقة الضوئية لإنتاج الغذاء، من ثاني أكسيد الكربون من الهواء، ومن ماء التربة. انظر : التركيب الضوئي. وهكذا يحول النبات الطاقة المشعة للضوء إلى طاقة كيميائية للغذاء. ومن خلال عمليات جيولوجية، تتحول النباتات إلى فحم حجري أو نفط. وعند احتراق هذا الوقود، تنطلق طاقة الضوء التي اخُتزنت في النباتات منذ ملايين السنيين.
تشمل العمليات الصناعية الكثيرة أيضاً تغيرات ضوكيميائية. ففي التصوير الضوئي، على سبيل المثال، تمتص بعضُ أملاح الفضة في فيلم التصوير الضَّوءَ عند التقاط الصورة. ويغيّر الضوءُ الممتصّ هذه الأملاح كيميائياً. وعندما يُحمَّض الفيلم تُصدر الأملاح المتغيرة صوراً مظلمة على السالب.
يتضمن البحث في الكيمياء الضوئية هذه الأيام تطوير الاستخدمات التقنية للطاقة الشمسية. ويسعى بعض علماء الكيمياء الضوئية إلى إيجاد طرق لتقليد عملية التركيب الضوئي بذرات مُخَلَّقة اصطناعيا. ويأمل هؤلاء الكيميائيون في تحويل ضوء الشمس إلى كهرباء بطريقة أكثر كفاءة مما هو ممكن الآن. ويدرس كيميائيون آخرون سبلاً لاستخدام ضوء الشمس في إنتاج أنواع من الوقود، مثل غاز الهيدروجين والميثانول. وتشمل بعض هذه الطرق تفتيت ذرات الماء مع الطاقة الشمسية.
قوانين الكيمياء الضوئية
يعرف قانونان أساسيان في الكيمياء الضوئية:
- القانون الأول، يعرف بأسم قانون جروتاس ـ درابر ( نسبة للكيميائيين C.J.T. de Grotthuss و John W. Draper )، و الذى ينص على أنه يجب على الضوء أن يمتص من قبل مادة كيميائية ليحدث تفاعل كيميائى ضوئى.[1]
- والقانون الثاني ، قانون ستارك ـ أينشتين ، والذى ينص على أنه لكل فوتون ضوئى يتم إمتصاصه من قبل نظام كيميائى ، فقط ـ جزىء واحد فقط يتم تنشيطه لأجل تفاعل كيميائى ضوئى. و ذلك القانون يعرف أيضا بقانون تساوى الضوء و الذى قام بإشتقاقه ألبرت أينشتين حينما كانت نظرية الكم(الفوتون) للضوء يتم تطويرها.ينص على أن العمليات الأولية الناتجة من امتصاص الضوء يساوي عدد الفوتونات الممتصة. وقد تحدث استثناءات للقانون الثاني أحياناً.
المناطق الطيفية
تطبيقات
تستعمل التفاعلات الكيمياوية الضوئية في اصطناع الجزيئات العضوية. كما أن كثيراً من العمليات العادية هي كيمياوية ضوئية في طبيعتها ولها تطبيقات عديدة، مثال ذلك: الاصطناع الضوئي (التمثيل الكلوروفيلي) photosynthesis، حيث يمتص الكلوروفيل في النبات الضوءَ لكي ينتج السكاكر carbohydrates، وهي مواد عضوية، من ثنائي أكسيد الكربون CO2 والماء H2O، المادتين اللاعضويتين، والتفاعلات الجارية خلال حدوث الرؤية في العين التي مازالت غير مفهومة حتى وقتنا الحالي. ويعتمد التصوير الضوئي photography على فعل الضوء في حبيبات كلوريد الفضة AgCl أو بروميد الفضة AgBr لإنتاج الصور. ويتكوَّن الأوزونO3 في طبقات الجو العليا بفعل الضوء على جزيئات الأكسجين O2.
والخلايا الشمسية التي تمد الأقمار الصناعية والمركبات الفضائية تحوِّل الطاقة الشمسية إلى طاقة كهربائية. فالتفاعلات الكيمياوية العادية تتم (ولو جرت في الظلام) بتوفير طاقة التنشيط activation energy اللازمة لها بوساطة الاصطدامات العشوائية المتتالية بين الدقائق (الجزيئات أو الذرات) المتفاعلة. أما في التفاعلات الكيمياوية الضوئية فتحصل الجزيئات أو الذرات المتفاعلة على طاقة التنشيط بامتصاص كمّ الطاقة الشعاعية وفق علاقة بلانك E =hnν حيث h ثابتة بلانك، وهو يساوي 6.624 جول × ثا، ν تردد (أو تواتر) الإشعاع.
الإعدادات التجريبية


Schlenk tubecontaining slurry of orange crystals of Fe2(CO)9 in acetic acid after its photochemical synthesis from Fe(CO)5. The mercury lamp (connected to white power cords) can be seen on the left, set inside a water-jacketed quartz tube.
لكي تبدأ العملية الكيمياوية الضوئية يلزم أن تمتص الذرة أو الجزيء طاقة ضوئية أو «كماً» quantum من الطاقة هو الفوتون. وعندها تزداد طاقة هذه الذرة أو الجزيء وتصبح أعلى من مستواها الطبيعي، أو تصبح في حالة مهيّجة (أو منشَّطة). وعندما يُمتص «كم» ضوء مرئي أو أشعة فوق بنفسجية يرتفع إلكترون موجود في سوية طاقية منخفضة نسبياً في الذرة أو الجزيء إلى سوية طاقية أعلى. أما إذا امتُص كم من أشعة تحت الحمراء فتتأثر عندها حركات الذرات في الجزيء.
وبعد الامتصاص المبدئي للأشعة، يُجري الجزيء المهيَّج عدداً من العمليات الكيمياوية الضوئية الأولية. والعملية الأولية تدل على التحول الذي يحدث مباشرة عندما يُمتَص فوتون ضوئي واحد في جزيء واحد. وتجري عملية ثانوية (أو عمليات ثانوية عدة) بعد الخطوة الأولية. فإذا رُمِز للجزيء بالرمز A وحدث امتصاص الفوتون الضوئي hnν، أمكن كتابة ذلك على النحو الآتي:
وتدل A* على الجزيء المهيَّج بعد امتصاصه الفوتونَ المناسب طاقياً.
الإثارة
يمتص الضوء في شكل كميات صغيرة من الطاقة المشعة فوتونات. وتعتمد طاقة الفوتون على طول موجة الضوء. وبعد امتصاص أحد الفوتونات، تزداد طاقة الجزيء ويكون في حالة إثارة. في معظم الحالات، يبقى الجزيء على هذه الحالة فقط واحدًا على مليون من الثانية أو أقل. وأحيانًا يعود الجزيء مباشرة لحالته العادية بِفقْدِ الطاقة المكتسبة في التصادمات مع الذرات الأخرى، أو بإطلاقها على هيئة ضوء. لكن إذا كان الطول الموجي لفوتون الضوء الممتص قصير ـ كما في الضوء المرئيّ ـ فإن الجزيء رُبمَّا يكون قد تلقى طاقة كافية ليمر بالتفاعلات الكيميائية غير العادية، بينما هو في حالة إثارة.
العمليات الكيمياوية الضوئية الأولية
يبيّن المخطط الآتي مختَلف العمليات الأولية التي يمكن أن تطرأ على الجزيء المهيَّج A*:
فالجزيء المنشَّط (ذو الطاقة العالية) يرجِع إلى حالته البدائية حسب إحدى العمليات الفيزيائية الآتية:
(1) يطلق طاقته المهيِّجة بالتألقluminescence.
(2) قد ينقل طاقته إلى جزيء آخر، C، يصطدم معه من دون إصدار ضوء. فيتحول A* المهيَّج إلى الجزيء الطبيعي A ويتحول C إلى C*
(3) قد يمتص إلكترون e- في عملية امتصاص الضوء الأولي طاقة كبيرة ما يؤدي إلى انفصاله عن الذرة أو الجزيء، فيتحول A إلى الأيون الموجب A+ وتسمى هذه العملية التأين الضوئي photoionization.
إن امتصاص طاقة التحريض يعمل على كسر الروابط الكيمياوية أو إعادة ترتيبها، وهذا يؤدي إلى حدوث تفاعلات كيمياوية مثل: التفكك الضوئي photodissociation، وإعادة ترتيب rearrangement الجزيء، والتفاعل مع جزيء آخر C. ففي التفكك الضوئي تنكسر A* متحولة إلى شدف جزيئية M وB أو ذرات. أما في إعادة الترتيب (أو التماكبية الضوئية photoisomerization مثل تحول البوتان إلى إيزوبوتان) فيتحول A إلى N، وهو جزيء يتألف من الذرات نفسها المؤلفة لـ A وعددها نفسه ولكن الترتيب البنيوي للذرات فيهما مختلف.
مثال ذلك تحول ثنائي كلورو الإتيلين المفروق trans إلى المماكب المقرون cis:
ففي المماكب المفروق تقع ذرتا الكلور باتجاهين متعاكسين بالنسبة للروابط المضاعفة، في حين هما تقعان في جهة واحدة من الرابطة المزدوجة في المماكب المقرون. وإذا أريدت الدقة تماماً فإن أمثال التحولات الثلاثة الأخيرة هي الموضوعات التي تُعنى بها الكيمياء الضوئية، إلا أن جميع التآثرات المذكورة في المخطط تندرج عادة ضمن الكيمياء الضوئية.
العمليات الكيمياوية الضوئية الثانوية
وتجري بعد إتمام الخطوة الأولية، مثال ذلك تكوّن الأوزون، وتحطّمه في طبقات الستراتوسفير، والتفاعلات المتسلسلة.